Présentation du cas clinique
En mars 2020, une patiente de 69 ans est référée par un centre hospitalier périphérique dans un CHU pour la prise en charge d’un syndrome myélodysplasique de type AREB 1.
Elle n’a pas d’antécédent notable et ne prend pas de traitement au long cours. Le diagnostic a été découvert devant une légère fatigue ayant amené son médecin traitant à réaliser une NFS. Celle-ci a révélé une anémie à 108 g/L, normocytaire arégénérative, une neutropénie à 1.3 G/L et une thrombopénie à 95 G/L. L’aspiration médullaire a retrouvé un excès de blastes à 8%. La cytogénétique était normale. En biologie moléculaire, il existait une mutation isolée de SRSF2. Le score IPSS est calculé intermédiaire à 1 et l’IPSS-R intermédiaire à 3.5. Une allogreffe de cellules souches hématopoïétiques (CSH) avec un donneur volontaire HLA -compatible est proposée.
Néanmoins, la patiente, peu symptomatique, n’est pas partante pour réaliser un traitement, que ce soit avec un agent hypométhylant ou une allogreffe. Une simple surveillance est donc initiée.
En Décembre 2020, ses cytopénies se majorent rapidement avec apparition d’une agranulocytose et d’une blastose périphérique. Le myélogramme retrouve une infiltration blastique à 55% signant l’évolution en LAM-MRC (figure 1). La cytogénétique est inchangée, l’analyse moléculaire ne retrouve pas de mutation NPM1, FLT3 ni IDH1/2, le panel NGS met en évidence des mutations TP53, CUX1 et STAG2. Aucun marqueur moléculaire n’est disponible pour le suivi de la maladie résiduelle. Elle présente de manière concomitante une bactériémie à staphylocoque epidermidis ainsi qu’une aspergillose pulmonaire invasive probable nécessitant une hospitalisation prolongée. L’évolution est finalement favorable sous antibiothérapie adaptée et voriconazole.
Devant l’aggravation de sa maladie, la patiente accepte une prise en charge adaptée et bénéficie d’une chimiothérapie d’induction intensive de type sujet âgé (cytarabine 100 mg/m2/ j 7 jours, idarubicine 8 mg/m2/j 5 jours, lomustine orale 200 mg/m2 1 dose) dans un essai clinique randomisant l’ajout versus placebo d’un agoniste de la thrombopoïétine (eltrombopag). Elle présente en fin d’aplasie une candidose disséminée à Candida krusei avec localisation cutanée et hépatosplénique, nécessitant un traitement prolongé par amphotéricine B liposomale. Le myélogramme à J45 confirme la rémission complète.
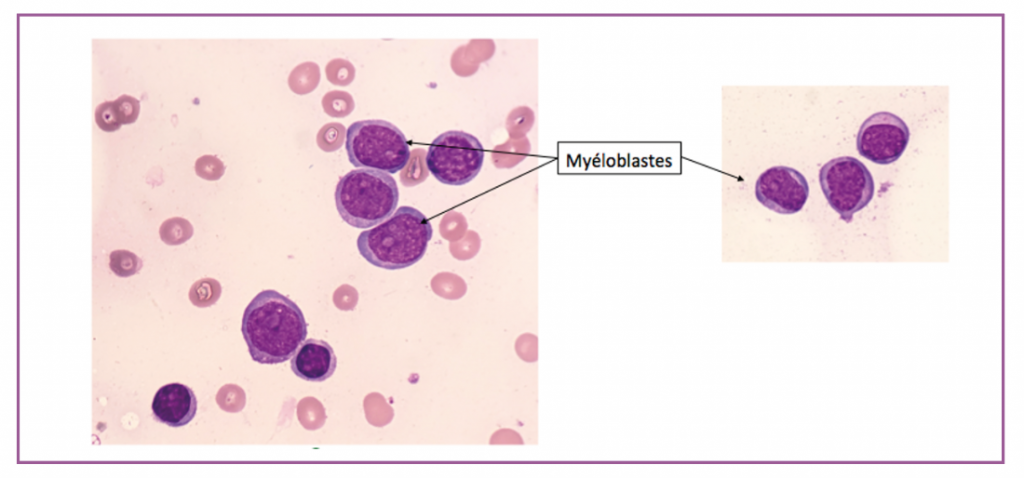
Figure 1 : frottis médullaire. Infiltration blastique massive. Évolution en LAM-MRC.
Il se pose alors la question du traitement post-rémission chez cette patiente de 70 ans en RC1 d’une LAM-MRC, en bon état général ECOG 1.
Il est alors décidé de poursuivre par 2 mini-consolidations protocolaires suivie d’une allogreffe de CSH avec conditionnement atténué à partir d’un donneur volontaire HLA-compatible.
En mars et avril 2021, les 2 mini-consolidations (idarubicine 10 mg/m2 1 dose, cytarabine sous-cutanée 100 mg/m2/j 5 jours) sont réalisées sans complication particulière.
En Juin 2021, alors que la patiente rentre en hospitalisation pour son allogreffe, elle dit avoir ressenti depuis quelques jours des lombalgies hyperalgiques morphino-requérantes et invalidantes sur le plan de sa mobilité, faisant découvrir des tassements ostéoporotiques L2-L3, sans argument pour une origine néoplasique ni infectieuse à l’IRM. Du fait d’un retentissement fonctionnel important, l’allogreffe ne nous semble pas réalisable en l’état, un traitement de maintenance par azacitidine orale est décidé dans le cadre de l’ATU de cohorte qui est obtenue rapidement.
La patiente débute son 1er cycle d’azacitidine orale 300 MG par jour pendant 14 jours consécutifs, sous couvert d’un traitement anti-émétique prophylactique par ondansetron. La tolérance hématologique est bonne, sans neutropénie significative ni besoin transfusionnel. La tolérance digestive est médiocre avec nausées et vomissements de grade 2, inappétence accompagnée de la perte de 2 kg (3% du poids corporel).
Le deuxième cycle est initié 4 semaines plus tard avec une baisse de la posologie à 200 MG par jour, améliorant nettement les symptômes digestifs.
En Septembre 2021, après le 3ème cycle, la NFS est normale et l’aspiration médullaire confirme la rémission cytologique complète.
Actuellement, le 6ème cycle est en cours à 200 MG par jour. La tolérance est parfaite, un état général satisfaisant est retrouvé.
Commentaires
Les leucémies aiguës myéloïdes sont caractérisées par la prolifération clonale au sein de la moelle osseuse et du sang de précurseurs hématopoïétiques myéloïdes peu différenciés, responsable d’une insuffisance médullaire avec survenue d’infections et de saignements potentiellement fatals. Depuis des décennies, la stratégie thérapeutique initiale repose sur une chimiothérapie d’induction de type « 7+3 » associant de la cytarabine arabinoside à une anthracycline dans le but d’obtenir une rémission complète, objectif atteint chez 60 à 80% des patients de moins de 60 ans et 40 à 60% des patients plus âgés. Néanmoins, la majorité des patients vont à terme rechuter, justifiant la mise en œuvre d’un traitement post-rémission. Celui-ci repose sur des chimiothérapies de consolidation, et, pour les patients éligibles et avec un donneur disponible, sur une allogreffe de CSH. En l’absence de greffe, aucun traitement de maintenance n’avait réellement fait la preuve de son intérêt.
Beaucoup d’essais cliniques testant des stratégies de maintenance ont été conduits avec différentes combinaisons de chimiothérapies, des agents hypométhylants et des traitements immunomodulateurs entre autres(1,2). La survie sans rechute a parfois été améliorée mais aucune étude n’avait démontré de réel bénéfice en termes de survie à long terme.
Une étude de phase 3 du GOELAMS randomisant l’ajout d’androgènes (noréthandrolone) pendant 2 ans chez des patients > 60 ans a permis d’améliorer la survie globale à 5 ans à 26% contre 17% chez les patients ayant reçu le placebo. Le bénéfice était plus important chez les patients dont la leucocytose au diagnostic était < 30 G/L. La tolérance clinique était excellente hormis des stigmates de virilisation chez certaines patientes, un suivi régulier des paramètres hépatiques et prostatiques était réalisé. À noter qu’il n’y a pas eu d’excès de cancers secondaires chez les patients traités par androgènes(3). Néanmoins, cette molécule est actuellement indisponible pour les 2 années à venir.
Concernant les patients avec une anomalie de FLT3 (ITD ou TKD), l’essai international de phase 3 RATIFY a montré un bénéfice en survie globale (51% vs. 44% à 4 ans) de l’ajout de la midostaurine pendant la phase d’induction puis de consolidation et en maintenance pendant 1 an chez les patients non allogreffés. Cet essai a permis l’obtention d’une AMM en France en 2017 pour la midostaurine, pour les LAM avec anomalie de FLT3 ITD et/ou TKD, comprenant une maintenance pendant 1 an(4). Cependant, le rôle de la maintenance reste débattu, l’essai RATIFY n’ayant pas été conçu pour répondre à cette question spécifique. Une analyse post-hoc dans le sous-groupe des patients ayant débuté une maintenance n’a pas permis de conclure(5).
Plus récemment, l’essai de phase 3 randomisé QUAZAR AML-001 a testé l’azacitidine orale versus placebo, en maintenance jusqu’à progression ou intolérance chez des patients de 55 ans ou plus, avec une LAM de pronostic intermédiaire ou défavorable en rémission complète (y compris avec une reconstitution hématopoïétique incomplète) après chimiothérapie d’induction et éventuellement de consolidation, et inéligible pour une allogreffe. La survie globale estimée à 2 ans est de 50.6% dans le groupe azacitidine orale versus 37.1% dans le groupe placebo. Ce bénéfice est retrouvé dans toutes les sous-catégories moléculaires (mutations de FLT3, de NPM1 et combinaison des 2). Les principaux effets secondaires sont d’ordre digestif, très fréquents surtout sur les 2 premiers cycles, rarement grave mais nécessitant la mise en place de traitements symptomatiques préventifs. Des effets indésirables sévères de grade 4 hématologique incluant les infections ont été rapportés chez 20% des patients. Treize pour cent des patients ont arrêté le traitement pour cause d’intolérance(6). Cette étude a permis l’approbation de cette molécule par la FDA en septembre 2020 et l’obtention d’une ATU de cohorte en France en Mars 2021.
Prise en charge
La stratégie post-rémission des LAM dépend à la fois des caractéristiques pronostiques de la maladie pour juger de son risque de rechute, et des caractéristiques du patient, notamment son âge et ses comorbidités afin de statuer sur son éligibilité à l’allogreffe.
Caractéristiques pronostiques des LAM : marqueurs cytogénétiques et moléculaires au diagnostic (classification actuelle de référence : l’European Leukemia Net de 2017) ainsi que la Minimal Residual Disease (MRD) mesurée par technique moléculaire et/ou par cytométrie de flux. Seuls les patients avec une LAM classée dans le groupe pronostique favorable n’ont pas d’indication d’allogreffe en première ligne, ni d’indication de maintenance par azacitidine orale. Les patients appartenant aux groupes intermédiaire et défavorable relèvent d’une discussion d’allogreffe et dorénavant d’un traitement d’entretien.
Caractéristiques du patient : l’évaluation combinée de son âge et de ses comorbidités va permettre d’estimer le risque de mortalité toxique liée à la procédure de greffe et par conséquent de statuer sur sa faisabilité. Le score le plus utilisé est l’Hematopoietic Cell Transplantation-specific Comorbidity Index (HCT-CI ou score de Sorror).
Comme l’illustre le cas de cette patiente, la décision d’allogreffe n’est pas toujours simple à prendre, d’autant plus que l’âge est avancé. Les risques de mortalité et de morbidité sont importants et les bénéfices à long terme moins évidents que chez les patients plus jeunes. La prise en compte de la qualité de vie est aussi primordiale, elle est actuellement étudiée dans un essai prospectif national (ELDER-GRAF) chez les patients de plus de 60 ans.
Le développement récent des stratégies de maintenance va probablement faire évoluer les indications d’allogreffe, surtout chez les patients âgés.
La figure 2 pourrait résumer la stratégie actuelle de maintenance dans la prise en charge des LAM :
– patients : inéligibles à une allogreffe ;
– LAM :
- avec anomalie de FLT3 : midostaurine pendant 1 an ;
- de pronostic intermédiaire ou défavorable en première rémission complète avec FLT3 sauvage :
o – azacitidine orale jusqu’à progression ou intolérance ;
o – discussion des androgènes en cas de leucocytose
au diagnostic < 30 G/L, lorsque le produit sera
de nouveau disponible.
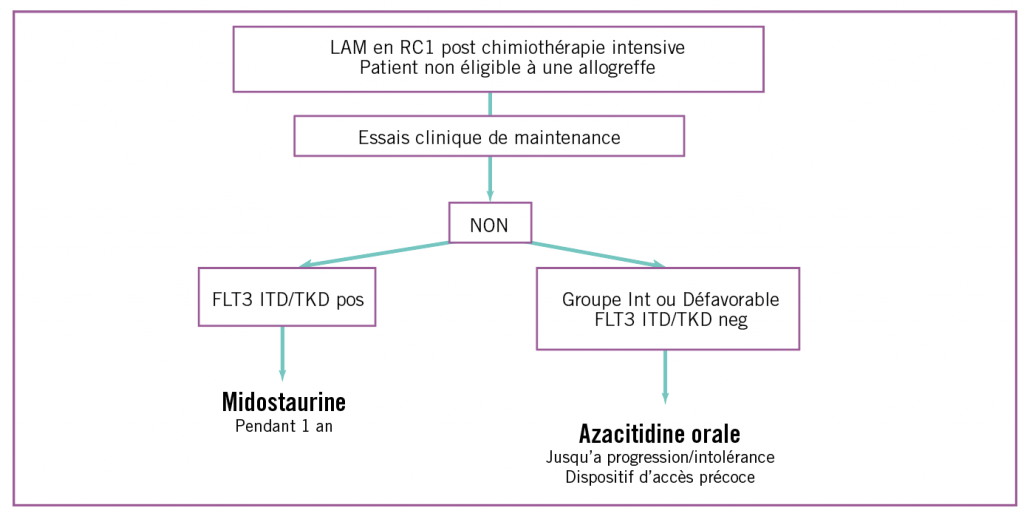
Figure 2 : proposition d’un algorithme de traitement de maintenance.
Conclusion
Malgré l’obtention d’une rémission complète après chimiothérapie intensive chez une grande proportion de patients atteints de LAM, la plupart d’entre eux vont rechuter, d’autant plus s’ils ne peuvent bénéficier d’une allogreffe.
La stratégie de maintenance n’a jamais cessé de faire partie des protocoles GOELAMS et FILO. Celle-ci s’impose progressivement à la communauté internationale depuis la publication des études RATIFY et QUAZAR AML-001. L’utilisation des androgènes semble aussi prometteuse et à moindre coût mais leur utilisation est actuellement limitée par des problèmes de production de la molécule. De nombreux essais cliniques sont en cours pour tester des associations thérapeutiques innovantes (agents hypométhylants, thérapies ciblées anti-FLT3, anti-IDH 1 ou 2, inhibiteurs de Bcl-2, agents différentiants, anticorps monoclonaux etc.). L’intergroupe ALFA-FILO est force de proposition et est en cours d’élaboration d’essais cliniques dans le domaine. Ces stratégies pourront à terme chalenger les indications d’allogreffe, en priorité chez les patients âgés.
Qualités souhaitables pour un traitement de maintenance :
- efficacité avec augmentation de la survie à long terme ;
- schéma adapté au risque de rechute, idéalement guidé par la MRD ;
- bonne tolérance ;
- le moins contraignant possible (prise orale, venues hospitalières limitées, durée définie dans le temps) ;
- possibilité de traitement à la rechute ;
- évaluation médico-économique favorable.
Références
- Reville PK, Kadia TM. Maintenance Therapy in AML. Front Oncol 2020; 10: 619085.
- De Lima M, Roboz GJ, Platzbecker U, Craddock C, Ossenkoppele G. AML and the art of remission maintenance. Blood Rev 2021; 49: 100829.
- Pigneux A, Béné MC, Guardiola P, et al. Addition of Androgens Improves Survival in Elderly Patients With Acute Myeloid Leukemia: A GOELAMS Study. J Clin Oncol Off J Am Soc Clin Oncol 2017; 35: 387–93.
- Stone RM, Mandrekar SJ, Sanford BL, et al. Midostaurin plus Chemotherapy for Acute Myeloid Leukemia with a FLT3 Mutation. N Engl J Med 2017; 377: 454–64.
- Richard A. Larson. An Analysis of Maintenance Therapy and Post-Midostaurin Outcomes in the International ProspectiveRandomized, Placebo-Controlled, Double-Blind Trial (CALGB10603/RATIFY [Alliance]) for Newly Diagnosed AcuteMyeloid Leukemia (AML) Patients with FLT3 Mutations. ASH. Atlanta, 2017.
- Wei AH, Döhner H, Pocock C, et al. Oral Azacitidine Maintenance Therapy for Acute Myeloid Leukemia in First Remission. N Engl J Med 2020; 383: 2526–37.








